第一节 再生
再生可分为生理性再生及病理性再生。生理性再生是指在生理过程中,有些细胞、组织不断老化、消耗,由新生的同种细胞不断补充,始终保持着原有的结构和功能,维持着机体的完整与稳定。例如,表皮的表层角化细胞经常脱落,而表皮的基底细胞不断地增生、分化,予以补充;消化道粘膜上皮约1~2天就更新一次;子宫内膜周期性脱落,又由基底部细胞增生加以恢复;红细胞平均寿命为120天,白细胞的寿命长短不一,短的如中性粒细胞,只存活1~3天,因此不断地从淋巴造血器官输出大量新生的细胞进行补充。本章乃指病理状态下细胞、组织缺损后发生的再生,称为病理性再生。
一、组织的再生能力各种组织有不同的再生能力,这是在动物长期进化过程中形成的。一般说来,低等动物组织的再生能力比高等动物强,分化低的组织比分化高的组织再生能力强,平常容易遭受损伤的组织以及在生理条件下经常更新的组织,有较强的再生能力。反之,则再生能力较弱或缺乏。按再生能力的强弱,可将人体组织细胞分为三类。
1.不稳定细胞(labile cells) 这类细胞总在不断地增殖,以代替衰亡或破坏的细胞,如表皮细胞、呼吸道和消化道粘膜被覆细胞、男性及女性生殖器官管腔的被覆细胞、淋巴及造血细胞、间皮细胞等。这些细胞的再生能力相当强。
2.稳定细胞(stable cells) 在生理情况下,这类细胞增殖现象不明显,似乎在细胞增殖周期中处于静止期(G0),但受到组织损伤的刺激时,则进入DNA合成前期(G1),表现出较强的再生能力。这类细胞包括各种腺体或腺样器官的实质细胞,如肝、胰、涎腺、内分泌腺、汗腺、皮脂腺和肾小管的上皮细胞等;还包括原始的间叶细胞及其分化出来的各种细胞。它们不仅有强的再生能力,而且原始间叶细胞还有很强的分化能力,可向许多特异的间叶细胞分化。例如骨折愈合时,间叶细胞增生,并向软骨母细胞及骨母细胞分化;平滑肌细胞也属于稳定细胞,但一般情况下其再生能力弱。
3.永久性细胞(permanent cells) 属于这类的细胞有神经细胞、骨骼肌细胞及心肌细胞。不论中枢神经细胞及周围神经的神经节细胞,在出生后都不能分裂增生,一旦遭受破坏则成为永久性缺失。但这不包括神经纤维,在神经细胞存活的前提下,受损的神经纤维有着活跃的再生能力。心肌和横纹肌细胞虽然有微弱的再生能力,但对于损伤后的修复几乎没有意义,基本上通过瘢痕修复。
二、各种组织的再生过程(一)上皮组织的再生
1.被覆上皮再生 鳞状上皮缺损时,由创缘或底部的基底层细胞分裂增生,向缺损中心迁移,先形成单层上皮,以后增生分化为鳞状上皮。粘膜如胃肠粘膜上皮缺损后,同样也由邻近的基底部细胞分裂增生来修补,新生的上皮细胞起初为立方形,以后增高变为柱状细胞。
2.腺上皮再生腺上皮虽有较强的再生力,但再生的情况依损伤的状态而异:如果仅有腺上皮的缺损而腺体的基底膜未被破坏,可由残存细胞分裂补充,完全恢复原来腺体结构。如腺体构造(包括基底膜)被完全破坏,则难以再生。构造比较简单的腺体如子宫腺、肠腺等可从残留部细胞再生。肝细胞有活跃的再生力,肝再生可分为三种情况:①肝大部分切除后,剩余的肝细胞分裂增生十分活跃,短期内就能使肝恢复原来的大小。例如大白鼠肝切除90%后,只需2周就可恢复原肝的重量,不过以后要经过较长时间的结构改建,形成新的肝小叶,才能恢复原结构。②肝细胞坏死时,不认范围大小,只要肝小叶网状支架完整,从肝小叶周边区再生的肝细胞可沿支架延伸,恢复正常结构。③肝细胞坏死较广泛,肝小叶网状支架塌陷,网状纤维转化为胶原纤维(网状纤维胶原化),或者由于肝细胞反复坏死及炎症刺激,纤维组织大量增生,形成肝小叶内间隔,此时再生肝细胞难以恢复原来小叶结构,成为结构紊乱的肝细胞团,例如肝硬变时的再生结节。
(二)纤维组织的再生
在损伤的刺激下,受损处的纤维母细胞进行分裂、增生。纤维母细胞可由静止状态的纤维细胞转变而来,或由未分化的间叶细胞分化而来。幼稚的纤维母细胞胞体大,两端常有突起,突起亦可呈星状,胞浆略显嗜碱性。电镜下,可见胞浆内有丰富的粗面内质网及核蛋白体,说明其合成蛋白的功能很活跃;胞核体积大,染色淡,有1~2个核仁。当纤维母细胞停止分裂后,开始合成并分泌前胶原蛋白,在细胞周围形成胶原纤维,细胞逐渐成熟,变成长梭形,胞浆越来越少,核越来越深染,成为纤维细胞(图2-1)。
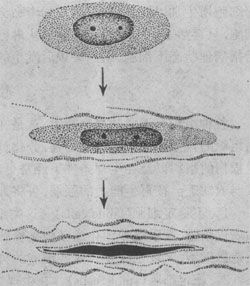
图2-1 纤维母细胞产生胶原纤维并转化为纤维细胞模式图
(三)软骨组织和骨组织的再生
软骨组织再生起始于软骨膜的增生,这些增生的幼稚细胞形似纤维母细胞,以后逐渐变为软骨母细胞,并形成软骨基质,细胞被埋在软骨陷窝内而变为静止的软骨细胞。软骨再生力弱,软骨组织缺损较大时由纤维组织参与修补。
骨组织再生力强,骨折后可完全修复。
(四)血管的再生
1.血管的再生 毛细血管多以生芽方式再生。首先在蛋白分解酶作用下基底膜分解,该处内皮细胞分裂增生形成突起的幼芽,随着内皮细胞向前移动及后续细胞的增生而形成一条细胞索,数小时后便可出现管腔,形成新生的毛细血管,进而彼此吻合构成毛细血管网(图2-2)。增生的内皮细胞分化成熟时还分泌IV型胶原、层粘连蛋白和纤维粘连蛋白,形成基底膜的基板。纤维母细胞分泌Ⅲ型胶原及基质,组成基底膜的网板,本身则成为周细胞(即血管外膜细胞)。至此毛细血管的结构逐告完成。新生的毛细血管基底膜不完整,内皮细胞间空隙较多较大,故通透性较高。为适应功能的需要,这些毛细血管还会不断改建:有的管壁增厚发展为小动脉、小静脉,其平滑肌等成分可能由血管外未分化间叶细胞分化而来。
2.大血管的修复 大血管离断后需的手术吻合,吻合处两侧内皮细胞分裂增生,互相连接,恢复原来内膜结构。但离断的肌层不易完全再生,而由结缔组织增生连接,形成瘢痕修复。
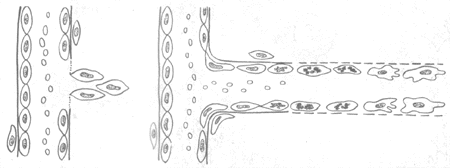
图2-2 毛细血管再生模式图
1.基底膜分解,内皮细胞肥大、增生,形成幼芽
2.内皮细胞向前移动,其后的内皮细胞分裂增生,靠近血管处的内皮细胞先分化成熟,并有新的基底膜形成
(五) 肌组织的再生
肌组织的再生能力很弱。横纹肌的再生依肌膜是否存在及肌纤维是否完全断裂而有所不同。横纹肌细胞是一个多核的长细胞,可长达4cm ,核可多达数十乃至数百个,损伤不太重而肌膜未被破坏时,肌原纤维仅部分发生坏死,此时中性粒细胞及巨噬细胞进入该部吞噬清除坏死物质,残存部分肌细胞分裂,产生肌浆,分化出肌原纤维,从而恢复正常横纹肌的结构;如果肌纤维完全断开,断端肌浆增多,也可有肌原纤维的新生,使断端膨大如花蕾样。但这时肌纤维断端不能直接连接,而靠纤维瘢痕愈合。愈合后的肌纤维仍可以收缩,加强锻炼后可以恢复功能;如果整个肌纤维(包括肌膜)均破坏,则难以再生,而通过瘢痕修复。
平滑肌也有一定的分裂再生能力,前面已提到小动脉的再生中就有平滑肌的再生,但是断开的肠管或是较大血管经手术吻合后,断处的平滑肌主要通过纤维瘢痕连接。
心肌再生能力极弱,破坏后一般都是瘢痕修复。
(六)神经组织的再生
脑及脊髓内的神经细胞破坏后不能再生,由神经胶质细胞及其纤维修补,形成胶质瘢痕。外周神经受损时,如果与其相连的神经细胞仍然存活,则可完全再生。首先,断处远侧段的神经纤维髓鞘及轴突崩解,并被吸收;近侧段的数个Ranvier节神经纤维也发生同样变化。然后由两端的神经鞘细胞增生,形成带状的合体细胞,将断端连接。近端轴突以每天约1mm的速度逐渐向远端生长,穿过神经鞘细胞带,最后达到末梢鞘细胞,鞘细胞产生髓磷脂将轴索包绕形成髓鞘(图2-3)。此再生过程常需数月以上才能完成。若断离的两端相隔太远(超过2.5cm时),或者两端之间有瘢痕或其它组织阻隔,或者因截肢失去远端,再生轴突均不能达到远端,而与增生的结缔组织混合在一起,卷曲成团,成为创伤性神经瘤(截肢神经瘤),可发生顽固性疼痛。为防止上述情况发生,临床常施行神经吻合术或对截肢神经断端作适当处理。
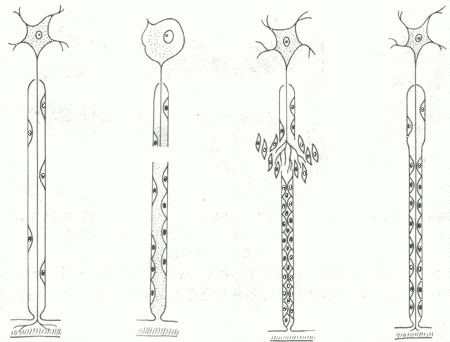
图2-3 神经纤维再生模式图
①正常神经纤维 ②神经纤维断离,远端及近端的一部分髓鞘及轴突崩解③神经膜细胞增生,轴突生长 ④神经轴突达末梢,多余部分消失
三、再生的调控就单个细胞而言,细胞增殖是受基因控制的,细胞周期出现的一系列变化是基因活化与表达的结果,已知的有关基因包括癌基因(oncogene)及细胞分裂周期基因(cell division cycle gene)。然而机体是由多细胞组成的极其复杂的统一体。部分细胞、组织丧失引起细胞再生予以修复,修复完后成再生便停止,可见机体存在着刺激再生与抑制再生两种机制,两者处于动态平衡。刺激再生的机制增强或抑制再生的机制减弱,则促进再生,否则再生受抑。目前已知短距离调控细胞再生的重要因素包括以下三方面。
1.细胞与细胞之间的作用 细胞在生长过程中,如果细胞相互接触,则生长停止,这种现象称为生长的接触抑制。细胞间的缝隙连接(可能还有桥粒)也许参与了接触抑制的调控。肿瘤细胞丧失了接触抑制特性。
2.细胞外基质对细胞增殖的作用 实验证明,正常细胞只有粘着于适当的基质才能生长,脱离了基质则很快停止于G1或G0期。基质各种成分对不同细胞的增殖有不同的作用,如层粘连蛋白可促进上皮细胞增殖,抑制纤维母细胞的增殖,而纤维粘连蛋白的作用则正好相反。组织中层粘连蛋白与纤维粘连蛋白的相对比值可能对维持上皮细胞与间质细胞之间的平衡有一定的作用。
3.生长因子及生长抑素的作用 近年来分离出许多因子,乃某些细胞分泌的多肽类物质,能特异性地与某些细胞膜上的受体结合,激活细胞内某些酶,引起一系列的连锁反应,从而调节细胞生长、分化。能刺激细胞增殖的多肽称为生长因子(cell growth factors),能抑制细胞增殖的则称为抑素(chalon)。
目前已分离、纯化出一些重要的生长因子,如①表皮生长因子(epidermal growth factor,EGF),对上皮细胞、纤维母细胞、胶质细胞及平滑肌细胞都有促进增殖的作用;②血小板源性生长因子(platelet derived growth factor,PDGF),来源于血小板α颗粒,在凝血过程中释放,对纤维母细胞、平滑肌细胞及胶质细胞的增生有促进作用;③纤维母细胞生长因子(fibroblast growth FGF),能促进多种间质细胞增生及小血管再生;④转化生长因子(transforming growth factor,TGF),最初从肉瘤病毒转化的细胞培养基中分离出来,故名。其实许多正常细胞都分泌TGF。TGF-α与EGF在氨基酸序列方面有33%~44%同源,也可与EGF受体结合,故有相同作用。TGF-β能刺激间质细胞增生;⑤许多细胞因子(cytokines)也是生长因子,例如白介素Ⅰ(IL-1)和肿瘤坏死因子(TNF)能刺激纤维母细胞的增殖及胶原合成,TNF还能刺激血管再生。此外还有许多生长因子,如造血细胞集落刺激因子、神经生长因子、IL-2(T细胞生长因子)等,在此不赘述。
与生子因子相比,对抑素的了解甚少,至今还没有一个抑素被纯化和鉴定。抑素具有组织特异性,似乎任何组织都可产生一种抑素抑制本身的增殖。例如已分化的表皮细胞能分泌表皮抑素,抑制基底细胞增殖。当皮肤受损使已分化的表皮细胞丧失时,抑素分泌中止,基底细胞分裂增生,直到增生分化的细胞达到足够数量和抑素达到足够浓度为止。前面提到的TGF-β虽然对某些间质细胞增殖起促进作用,但对上皮细胞则是一种抑素。此外干扰素-α,前列腺素E2和肝素在组织培养中对纤维母细胞及平滑肌细胞的增生都有抑制作用。
