第四节 微粒体甘油三酯转移蛋白
WetterauJ.R等于1984年发现肝细胞微粒体的离子强度缓冲液里有加速甘油三酯和胆固醇酯转运作用,用Bio-Gel A-5m和Hydroxylapatite纯化,并监测其活性,发现该蛋白的激活作用促进甘油三酯转运的活力大。经凝胶过滤测得分子量约为150kD,部分纯化产品等电点为pH5.2~5.6,该蛋白即为微粒体甘油三酯转移蛋白(microsmal triglyceridetransfer protein, MTTP)。
一、MTP蛋白质结构及特性1991年,Wetteran J R等发现MTR由58kD和88kD的两种亚基组成的异二聚体复合物。这一特点使之与以前报道的脂质转运蛋白加以区别,以前报道的脂质转运蛋白是单一多肽,分子量从8kD到53kD不等,发现几种哺乳动物包括人的血浆中的胆固醇酯转运蛋白(CETP),均属于糖蛋白,分子量为74kD,含一个53kD的多肽骨架。
MTP的58kD的小亚基通过氨基酸分析和免疫化学分析表明他是蛋白二硫键异构酶(protein disulfide isomerase,PDI;EC5.3.4.1)早在1963年就在肝和胰腺组织中发现此酶,其功能之一是催化蛋白质生物合成中的二硫键形成,具有较宽的底物特异性。PDI在新鲜制备的鼠肝微粒体中未能检测其活性,但破膜后,可检测到二硫键异构酶活性。PDI是一种多功能蛋白,据报道他又是脯氨酰-4-羟化酶(prolyl 4-hydroxylase)的β亚单位;还与寡糖基转移酶的糖化位点结合蛋白亚组分高度相似。PDI羧基端序列Lys-Asp-Glu-Leu与内质网上相应受体结合,使之与88kD组分一起保留在内质网腔内,PDI基因定位在17号染色体。据估计,牛肝内质网腔中游离PDI浓度超过MTP中PDI浓度的五倍。此,PDI自我组装成二聚体和四聚体。MTP中PDI的二硫键异构酶活性仅是自由PDI的十分之一。
用沉降平衡实验表明,这种150kD的MTP有三种不同的沉降速率。他们分别是MTP、PDI和一个88kD的亚基。进一步用SDS-聚丙烯酰胺凝胶电泳,考马斯亮蓝染色测定一定量MTP中PDI含量,与标准PDI比较,表明PDI:88kD亚基之比为1:0.98~1.30,证明MTP中58kD的PDI和88kD亚基化学计量为1:1。通过超速离心发现沉降系数为5.85,Stoke半径为4.7μm。用盐酸胍变性实验表明,MTP可抵抗0.8M盐酸胍的变性作用,PDI与88kD亚基结合稳定。PDI与MTP大亚基作用不可逆,到目前为止,试图用其组分或外源PDI重建MTP复合体还未功能。通过远紫外圆二色光谱分析表明,MTP约有28%α螺旋和随机结构(分别为31%和34%),而88kD亚基的β折叠占35%。
MTP的大亚基与已发现的蛋白相比未发现高度同源性。Shoulders等从MTP辨认出几个区域与卵黄磷脂蛋白的序列有低水平同源性。卵黄磷脂蛋白是产卵动物中脂蛋白复合体的蛋白质组分,由卵黄生成素裂解而成。基于氨基酸序列、分子模型和基因结构的比较,认为MTP大亚单位是卵黄生成素基因家族成员之一。
二、MTP基因结构1993年Sharp D.等克隆MTP 88kD大亚基的cDNA并进行序列分析,比较人和牛的cDNA表明有88%核苷酸序列相同,在人MTP大亚基的3‘末端有基因组DNA编码的18个腺苷酸残基,预测的分子量97kDa,人和牛MTP大亚基单位氨基酸有86%同源性,加上保守性氨基酸替换,人与牛MTP大亚基单位有94%同源性。在核苷酸和蛋白序列数据库中未发现其他蛋白与之同源。
SharpD.等MTP88kD大亚基基因结构进行分析(图7-7)。其基因跨越55~60Kb,由18个外显子组成,外显子1和18也分别包括5‘和3‘的非编码序列。除掉含非编码序列的外显子1和18,平均每个编码外显子的长度是153bp。
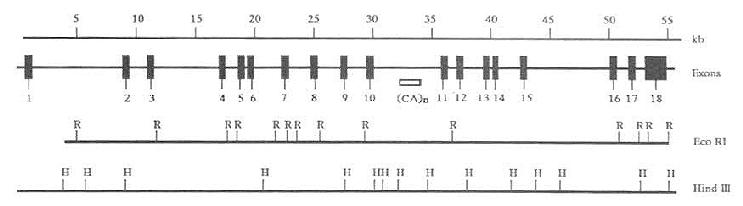
图7-7 人MTP大亚基的基因结构
上线表明基因跨度;第二线为MTP大亚基的18个外显子
示意图;第三四线分别是EcoRI(R)和Hind(H)的酶切位点。
SharpD等早期报道,人MTp cDNA 5‘端非编码区有64个核苷酸。用锚定PCR检测MTpcDNA的5‘末端,从两个独立PCR产物的直接序列分析揭示,从翻译起始的上游有86bp的非编码序列(见图7-8)。所有86bp5‘端非翻译区均编码外显子1,外显子1还有61bp编码信号肽及成熟蛋白2个氨基酸。在翻译起始框外上游25bp有一个ATG,但该处没有适合的起始环境,第二个ATG是真正的翻译起始点。

图7-8 MTP大亚基的5‘侧翼序列
转录起始点5‘侧翼序列不含TATA盒,但富含AT序列,在转录起始点上游约30bp的AAAGATAAA可能被TATA结合蛋白(TFⅡD)识别。用Nothern blot杂交及分析MTP活性表明MTP在肝和肠表达,在卵巢、睾丸和肾也发现有低水平MTp mRNA表达。计算机辅助分析转录起始点上游743bp序列表明,他与几种已知顺式作用元件同源,可调节MTP组织特性性表达。在转录起始点第一个200bp序列含肝特异C/EBP、HNF-1和HNF-5转录因子识别的上游启动子元件,该区还含有通用转录因子Sp-1和Ap-1识别序列。Sp-1,C/EBP、HNF-1和HNF-5在该区的位点有单个碱基错配。其他比第一个200bp更上游的顺式元件可被HNF-5,C/EBP和CTF/NF-1识别。
MTP大亚基限制性片段长度多态性分析或简单序列的串联重复多态性分析,均可用于调查MTP基因与异常血浆脂类或脂蛋白代谢的联系。CA双核苷酸重复多态性在人基因组随处可见,这种重复可用PCR分析,因而是一种理想的基因标记。为了识别CA双核苷酸重复序列,用一个CA重复的探针来与MTP大亚基因进行杂交,在内含子10发现非完整CA重复结构(CA)4AA(CA)3GA(CA)4TA(CA)nTACA,分析18个不相关个体的36个等位基因表明有8种变异,n从8到17。荧光原位杂交表明MTP大亚基基因位于4号染色体,即4q28-q31。
三、MTP生理功能和基因突变脂质转运蛋白促进膜间不溶性脂类分子转运,MTP的特性在于他剌激膜间中性脂类(甘油三酯、胆固醇酯、磷脂酰胆碱)转运。脂质转运蛋白也能促进膜间脂质分子交换或促进从一种膜向另一种膜净转运脂质分子,虽然有例外,但在体外分析表明脂质转运蛋白一般是促进膜间脂质分子交换。当供体和受体膜间TG浓度相等时,MTP能促进膜间交换TG,而且当供体和受体膜间中性脂类浓度不平衡,中性脂类仍可转移到受体颗粒,表明MTP能净转运TG和CE。MTP存在于肝细胞和小肠细胞微粒体腔内,在富含甘油三酯的脂蛋白的正常组装、分泌中起有重要作用。用MTP抑制剂研究表明,MTP在含ApoB48脂蛋白组装的早期而不是晚期起作用,光亲和MTP抑制剂能阻断McArdle RH-7777细胞分泌含ApoB的脂蛋白,当这种细胞在缺乏MTP抑制剂和油酸时,贫脂质(HDL)的ApoB48颗粒可以形成,但不能分泌。油酸加入这种培养细胞后可转化成能分泌的富脂质的颗粒。然而,如果在贫脂复合体形成之后加入MTP光亲和抑制剂,则对这种转化或分泌过程没有作用。
1992年Wetterau J.R等报道无β脂蛋白血症患者MTP活性和MTP蛋白缺陷。SharpD.等1993年从一个无β脂蛋白血症患者取小肠活检,该患者是近亲婚配的女性后代,39岁,用RT-PCR结合序列分析表明215位胞嘧啶缺失,导致发生移码突变,移码突变导致在下游21个碱基处过早形成一个终止密码,并预测翻译产物为78个氨基酸。进一步分析发现该患者是移码突变的纯合子。从一个14岁女性无β脂蛋白血症患者发现1783位C→T转换,这个突变使Arg密码变成终止密码,产生594个氨基酸的截短产物。这个无义突变消除了一个TaqⅠ限制性内切酶位点。Southern杂交分析表明该患者为纯合子,而其父母都是含正常和突变的杂合子。为检测这些突变对MTP的影响,将PDI和野生或突变MTP大亚基用杆状病毒表达系统在sfq昆虫细胞共同表达。用表达PDI和野生MTP大亚基病毒共传染sfp细胞,可产生有活性的MTP。相反,用表达PDI和突变MTP大亚基病毒共传染sfq细胞,则不能产生有活性蛋白,突变蛋白也形成不容性凝聚体,不能与PDI结合。该结论可用解释无β脂蛋白血症患者的突变后MTP活性和MTP蛋白的缺陷。到目前为止,MTP大亚基的突变有码突变、无义突变及点突变改变了MTP的正常剪接。
